A aprovação de medicamentos nos Estados Unidos, historicamente um processo longo e rigoroso, está prestes a passar por uma transformação inédita. A Food and Drug Administration (FDA) anunciou que todos os seus centros integrarão ferramentas de inteligência artificial (IA) até 30 de junho de 2025. A decisão marca um passo estratégico rumo à agilidade regulatória, após um programa piloto que provou a eficácia da tecnologia na redução de tarefas repetitivas — sem comprometer a segurança ou o rigor técnico. Neste artigo, você entenderá como a IA está revolucionando a regulação farmacêutica e o que isso significa para o futuro da saúde global.
Por que a FDA está adotando a inteligência artificial?
A FDA é reconhecida mundialmente pelo seu padrão elevado de segurança e eficácia na aprovação de medicamentos. No entanto, o tempo médio para aprovar um novo fármaco pode ultrapassar 10 anos, considerando todas as fases de testes clínicos e análises regulatórias.
Com a IA, o órgão pretende:
- Automatizar tarefas administrativas repetitivas.
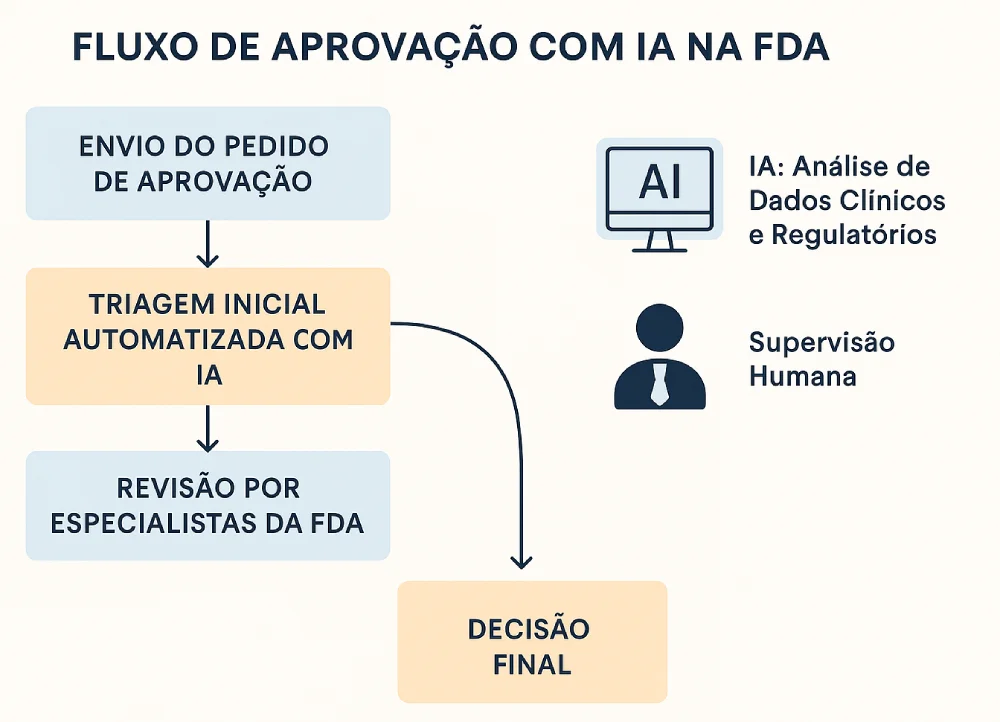
- Agilizar a triagem e análise de dados clínicos.
- Aumentar a produtividade sem comprometer a qualidade.
- Reduzir o tempo total de revisão regulatória.
A agência enfatizou que todas as ferramentas serão usadas de forma interna, sem interferência em decisões automatizadas, garantindo que a responsabilidade e o julgamento humano sejam mantidos.

Resultados do programa piloto da FDA
Em 2024, a FDA concluiu um piloto interno em parceria com centros de revisão de medicamentos e tecnologias emergentes. O projeto testou algoritmos de processamento de linguagem natural (NLP) para organizar dossiês regulatórios e identificar informações-chave.
Resultados do piloto:
- Redução de até 40% no tempo de leitura técnica de certos documentos.
- Diminuição significativa de erros manuais na triagem de dados.
- Aumento da eficiência na priorização de pedidos urgentes, como terapias inovadoras e vacinas.
Segundo o relatório interno, a IA funcionou como uma “ferramenta de apoio à decisão”, sem substituir a análise de especialistas.
Segurança e ética no uso da IA pela FDA
A FDA destacou que a expansão do uso de IA seguirá protocolos rígidos de segurança da informação, com foco especial na confidencialidade de dados sensíveis e na aderência às normas regulatórias.
As diretrizes da agência incluem:
- Auditorias contínuas dos sistemas de IA.
- Transparência nos critérios de análise algorítmica.
- Garantia de supervisão humana em todas as etapas.
- Proteção contra viés algorítmico nos processos.
Essa abordagem equilibrada busca unir inovação tecnológica com responsabilidade regulatória.
Visão de Especialista
“A decisão da FDA é histórica — a IA será o catalisador para uma regulação mais eficiente, sem perder de vista a ética e a segurança”,
Dr. Alan Hughes, Diretor do Centro de Inovação em Regulação da Saúde da Johns Hopkins University.
Impactos para a indústria farmacêutica e para os pacientes
A implementação da IA na FDA deve beneficiar diretamente a cadeia de inovação biomédica:
- Empresas farmacêuticas terão respostas mais rápidas sobre seus pedidos.
- Startups de biotecnologia ganharão fôlego com processos menos burocráticos.
- Pacientes poderão ter acesso mais ágil a medicamentos inovadores e terapias de ponta.
Essa transição digital pode se tornar referência global para outros órgãos reguladores, como a EMA (Europa) e ANVISA (Brasil).
Conclusão: um novo ciclo na regulação de medicamentos
A iniciativa da FDA demonstra como a inteligência artificial pode ser aplicada de forma estratégica no setor público, acelerando processos sem comprometer a confiança.
Principais aprendizados:
- A IA reduz tarefas repetitivas e aumenta a eficiência regulatória.
- A supervisão humana e a segurança da informação continuam como pilares essenciais.
- A medida pode impactar positivamente a saúde pública e a inovação farmacêutica global.
Com essa mudança, a pergunta que fica é: será que outros países seguirão o exemplo?
Se você achou este conteúdo útil, compartilhe com colegas da área de saúde ou tecnologia.









